Un acide faible est un acide qui ne se dissocie pas totalement dans l'eau,.
Définition
Lorsqu'un acide faible AH est mis en présence d'eau, la réaction suivante a lieu :
- .
La réaction n'est pas totale mais équilibrée : il reste toujours de l'acide AH en solution.
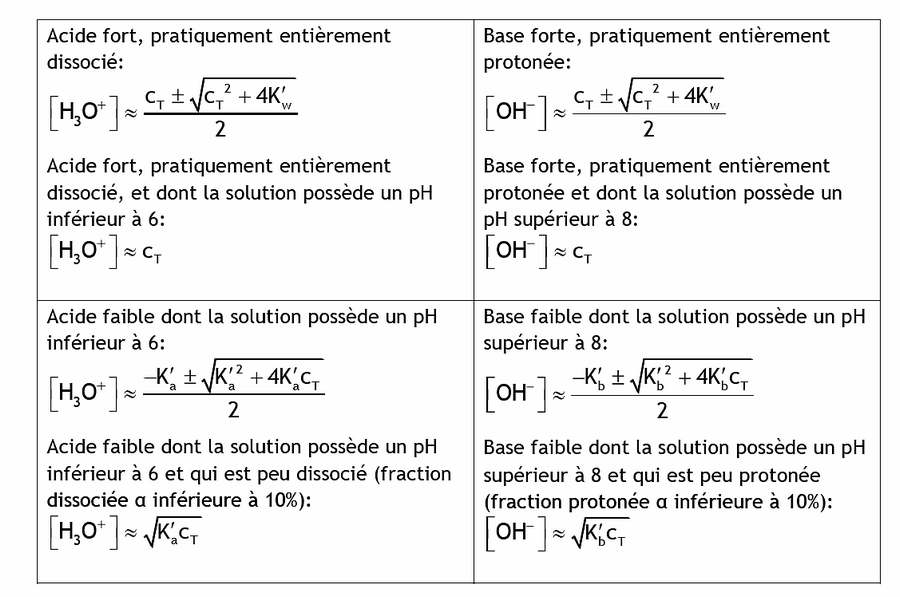
On classe les acides faibles en fonction de leur constante d'acidité, c'est-à-dire en fonction de leur capacité à plus ou moins se dissocier en présence d'eau. On considère qu'un acide est faible lorsque son pKa est supérieur à −1,74 à 25 °C (pKa du cation hydronium H3O ). Pour un pKa supérieur à 14, on dit qu'il est indifférent. Un acide est d'autant plus faible que son pKa est élevé. Sa base conjuguée est donc d'autant plus forte et moins stable que ce même pKa est élevé.
Exemples
- Acides organiques comme les acides carboxyliques : acide méthanoïque, acide acétique.
- Acides minéraux : acide fluorhydrique (HF), acide hypochloreux (HOCl), acide borique (H3BO3), acide sulfureux (H2SO3), acide cyanhydrique (HCN).
Notes et références
Articles connexes
- Acide fort
- Portail de la chimie